
一种微流控多尺寸细胞球阵列芯片,用于评估抗癌药毒性和血脑屏障穿透率。
Introduction
思路:
- 药物开发的成本成倍增加,大多数候选药物在临床Ⅰ、Ⅱ、Ⅲ期被淘汰,这种高失败率主要归因于在早期临床前阶段使用的标准体外/体内模型缺乏可预测性。
- 多细胞球可以模拟人类(病理)生理,被认为是可以弥补临床前试验和体内试验结果之间的差距,可以缩短药物开发时间、提供有意义和有代表性的测试结果,从而可能大大降低药物开发成本。
- 多细胞球的优点:
- 更具预测性和可重复性的毒性/药效测试;
- 尽早剔除药物研发管线中的候选药物;
- 对相关人类疾病模型进行实质性测试的可能;
- 减少动物研究,从而遵循3R原则(替代、减少、优化)。
- 存在问题:培养流程缺乏标准化和协调性,导致球状体形态、使用的细胞数量和比例、培养基成分和培养/检测时间等方面存在很大差异,因此不同实验室无法进行有意义的比较。
- 多细胞球体的尺寸会影响氧气、生长因子、营养(如糖、肽、蛋白质)、离子和pH值的梯度分布,以及引导消除球体内部代谢废物;从药物筛选来看,不同大小的细胞球会影响药物的渗透、分布和保留,产生与球尺寸相关的药物反应。
- 传统的多细胞球培养方法中,只有悬滴法和微孔法可以实现尺寸可控的均匀球体,但它们费力且可能存在技术难度。而大多数微流控多细胞球培养技术仍然不能实现三维细胞球的自动生成、培养以及在单个芯片平台上形成不同大小的球体。
- 因此作者提出一种微流控多尺寸细胞球阵列,能够高通量生成不同类型的多细胞球。
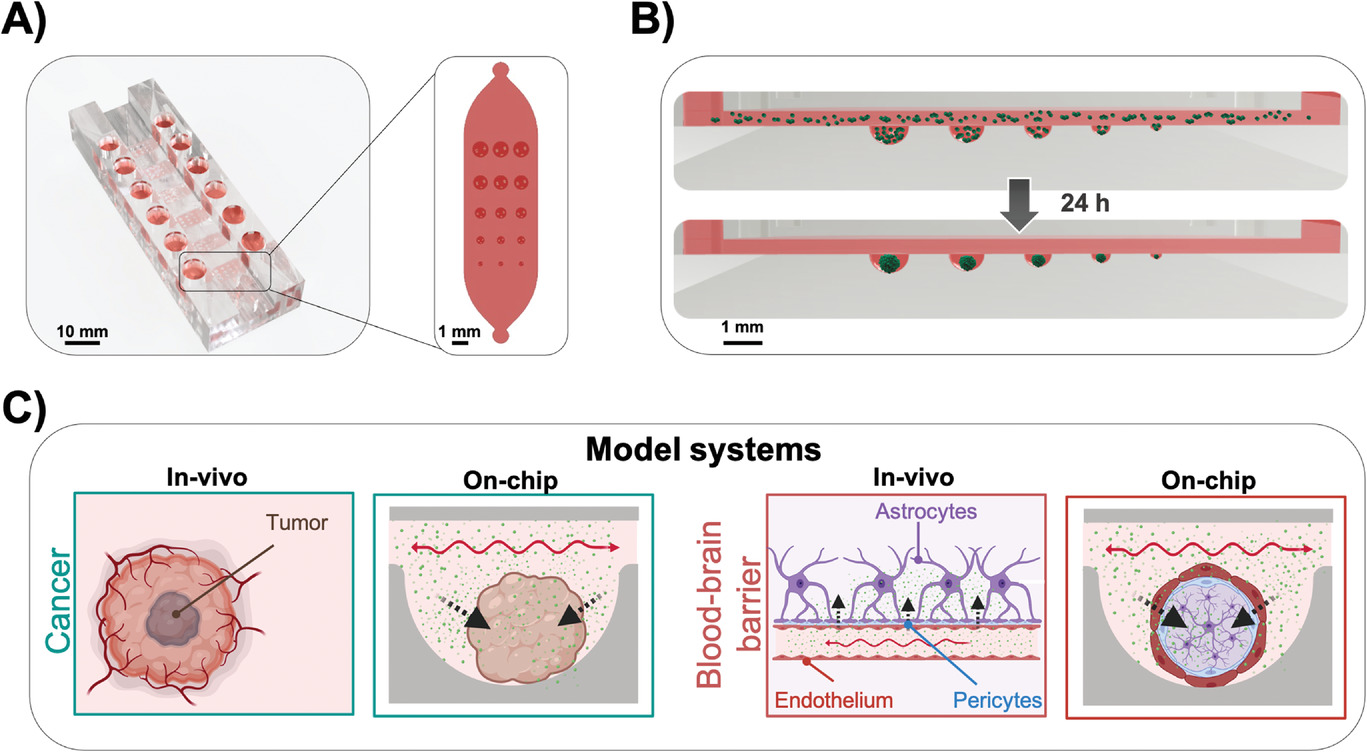
- (A)芯片剖面图,包含6个通道,可以生成90个不同尺寸(1000、900、700、500和300 μm)的多细胞球。同时可以与标准多通道移液器兼容。
- (B)24小时内生成多细胞球的过程,其微孔通过2-(甲基丙烯酰氧基)乙基磷酰胆碱 (MPC)聚合物表面改性。
- (C) 已建立的细胞模型系统概述,包括用于药物筛选应用的肿瘤球模型和三维血脑屏障(BBB)模型。
Identification of Best Microwell Dimensions for the Formation of Multisized Spheroids
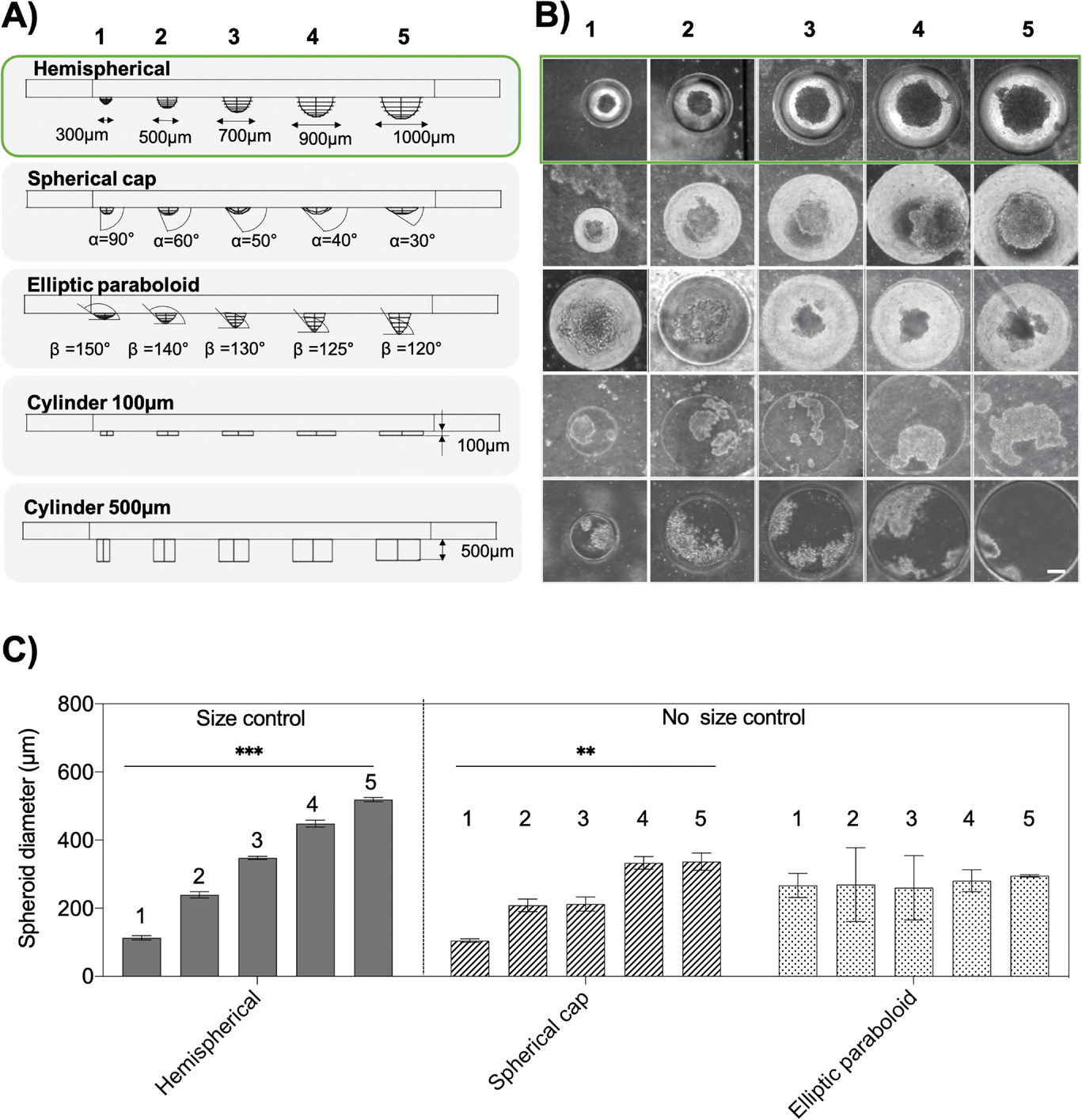
- (A)多种设计以评估不同形状微孔(半球、球冠、椭圆抛物面和圆柱体)可重复生成均匀细胞球的能力。
- (B)培养3天后的芯片上HepG2肿瘤球的白光图。表明半球形的微孔最适合生成肿瘤球。
- (C) 通过评估 HepG2比较不同尺寸微孔产生的肿瘤球大小,只有半球形微孔形状才能可靠地生成线性方式增大的肿瘤球,椭圆抛物面和球冠形微孔则会生成不规则的肿瘤球。
Table 1. Optimization of microwells by evaluating a number of spheroids per well, spheroid roundness, and spheroid center-to-microwell center-distances.
| Parameter | Hemispherical | Spherical cap | Elliptic paraboloid | Cylinder 100 µm | Cylinder 500 µm | |
|---|---|---|---|---|---|---|
| Spheroid number per well (optimum: 1.0) | 1 | 1.0 ± 0.0 | 1.0 ± 0.0 | 1.0 ± 0.0 | 2.3 ± 0.6 | 1.3 ± 0.6 |
| 2 | 1.0 ± 0.0 | 1.3 ± 0.3 | 1.0 ± 0.0 | 2.7 ± 1.2 | 1.7 ± 0.6 | |
| 3 | 1.0 ± 0.0 | 1.0 ± 0.0 | 1.0 ± 0.0 | 6.3 ± 2.1 | 2.7 ± 0.6 | |
| 4 | 1.0 ± 0.0 | 1.3 ± 0.5 | 1.3 ± 0.6 | 6.0 ± 1.7 | 3.7 ± 1.2 | |
| 5 | 1.0 ± 0.0 | 1.7 ± 0.6 | 1.0 ± 0.0 | 7.7 ± 1.5 | 3.0 ± 1.0 | |
| Roundness per well [AU] (optimum ≥ 0.9) | 1 | 1.0 ± 0.0 | 0.9 ± 0.0 | 0.9 ± 0.0 | 0.5 ± 0.0 | 0.5 ± 0.2 |
| 2 | 1.0 ± 0.1 | 0.9 ± 0.0 | 1.0 ± 0.0 | 0.6 ± 0.1 | 0.5 ± 0.0 | |
| 3 | 0.9 ± 0.0 | 0.9 ± 0.0 | 0.8 ± 0.0 | 0.6 ± 0.1 | 0.5 ± 0.1 | |
| 4 | 0.9 ± 0.0 | 0.9 ± 0.0 | 0.8 ± 0.0 | 0.7 ± 0.1 | 0.5 ± 0.0 | |
| 5 | 0.9 ± 0.0 | 1.0 ± 0.0 | 0.7 ± 0.0 | 0.5 ± 0.0 | 0.5 ± 0.1 | |
| Center-to-center distance per well [µm] (optimum = 0 µm) | 1 | 5.4 ± 6.6 | 47.3 ± 25.7 | 27.3 ± 19.1 | 76.1 ± 26.4 | 89.3 ± 25.60 |
| 2 | 16.3 ± 8.0 | 55.4 ± 33.9 | 23.3 ± 17.7 | 138.4 ± 54.1 | 121.6 ± 31.7 | |
| 3 | 18.5 ± 7.5 | 31.7 ± 0.1 | 4.8 ± 1.7 | 228.2 ± 54.8 | 244.7 ± 26.3 | |
| 4 | 10.3 ± 2.0 | 40.0 ± 5.5 | 26.3 ± 29.6 | 280.4 ± 146.5 | 316.5 ± 59.6 | |
| 5 | 10.1 ± 6.3 | 53.9 ± 32.3 | 23.9±20.9 | 376.0 ± 113.6 | 410.0 ± 12.7 |
Characterization of Dynamic Culture Conditions Using a Bidirectional Hydrostatic Flow

- (A)通过摇床控制液体流动的方案。其优势为①可通过修改倾斜角度和速度来调整流动剖面②减少气泡形成③重现血液循环的脉动性质。
- (B)倾斜速度为1、3和4 rpm且固定角度为1°时的流动曲线。
- (C-D)以恒定1 rpm的速度和1°的倾角在通道中产生的(C)流速和(D)剪切应力。
Table 2. Experimental versus in silico data of maximum flow rates as a function of tilting angles at a constant frequency of 1 rpm.
| Tilting angle | |||||
|---|---|---|---|---|---|
| Flow rate [µL min−1] | 1° | 3° | 5° | 7° | 10° |
| Experimental | 15.7 ± 9.2 | 57.6 ± 22.9 | 90.0 ± 28.6 | 126.3 ± 33.1 | 176.0 ± 33.9 |
| Simulation | 17.9 ± 0.0 | 53.8 ± 0.08 | 89.5 ± 0.1 | 125.1 ± 0.1 | 175.4 ± 0.2 |
On-Chip Generation of Multitissue Spheroids and Characterization of Linear Size-Control Strategy

- (A-D)增加接种密度的情况下使用(A)肺癌A549、(B)肝癌HepG2、(C)结肠癌Caco-1和(D)皮肤成纤维(NHDF)细胞培养3天后测量细胞球直径,以阐明初始细胞接种浓度与细胞球大小之间的关系。因此,①通过改变初始细胞接种密度可以可靠地生成不同大小范围的细胞球②可以使用该阵列芯片轻松评估细胞系特定的生长差异。
Table 3. Linear regression analysis and goodness-of-fit (R2) values of generated sizes after 3 d postseeding of A549, HepG2, Caco-2, and NHDF spheroids in respect to initial seeding densities Statistical significance of respective slopes was determined by analysis of covariance (ANCOVA).
| Seeding density [cells mL−1] | |||||||
|---|---|---|---|---|---|---|---|
| Cell line | 1.0 × 105 | 2.5 × 105 | 5.0 × 105 | 7.5 × 105 | 1.0 × 106 | 3.0 × 106 | p-value of slopes |
| A549 | 0.8336 | 0.8388 | 0.8251 | 0.8725 | 0.8938 | 0.8747 | P < 0.0001 |
| HepG2 | 0.2701 | 0.4697 | 0.8278 | 0.6739 | 0.7988 | 0.8345 | P < 0.0001 |
| Caco-2 | 0.1977 | 0.7552 | 0.7915 | 0.8140 | 0.9175 | 0.9662 | P < 0.0001 |
| NHDF | 0.3463 | 0.3968 | 0.5596 | 0.5502 | 0.7430 | 0.7935 | P = 0.1387 |
Multiparametric Monitoring of Multitissue Spheroids On-Chip

- (A)代表性的白光/荧光显微图片,用于评估阵列中细胞球的形态、细胞内酯酶活性和缺氧情况。
- (B)不同尺寸的A549、HepG2、Caco-2和NHDF细胞球的面积、周长、圆度和密实度(Solidity)的形态测量分析。表明所有细胞系均不存在显著的圆度和密实度差异,该芯片可以让各种细胞系生成稳定且可重复的细胞球。
- (C-D)接种的四种细胞系在第3 d和第12 d的(C)钙黄绿素和(D)缺氧荧光强度。就NHDF的情况来看,缺氧会同步刺激成纤维细胞的酯酶活性提高。而从肿瘤球第3 d没有信号可以看出肿瘤球拥有更高的缺氧恢复能力。
Spheroid Size-Dependent Tissue Diffusivity and Toxicity of Anticancer Drugs
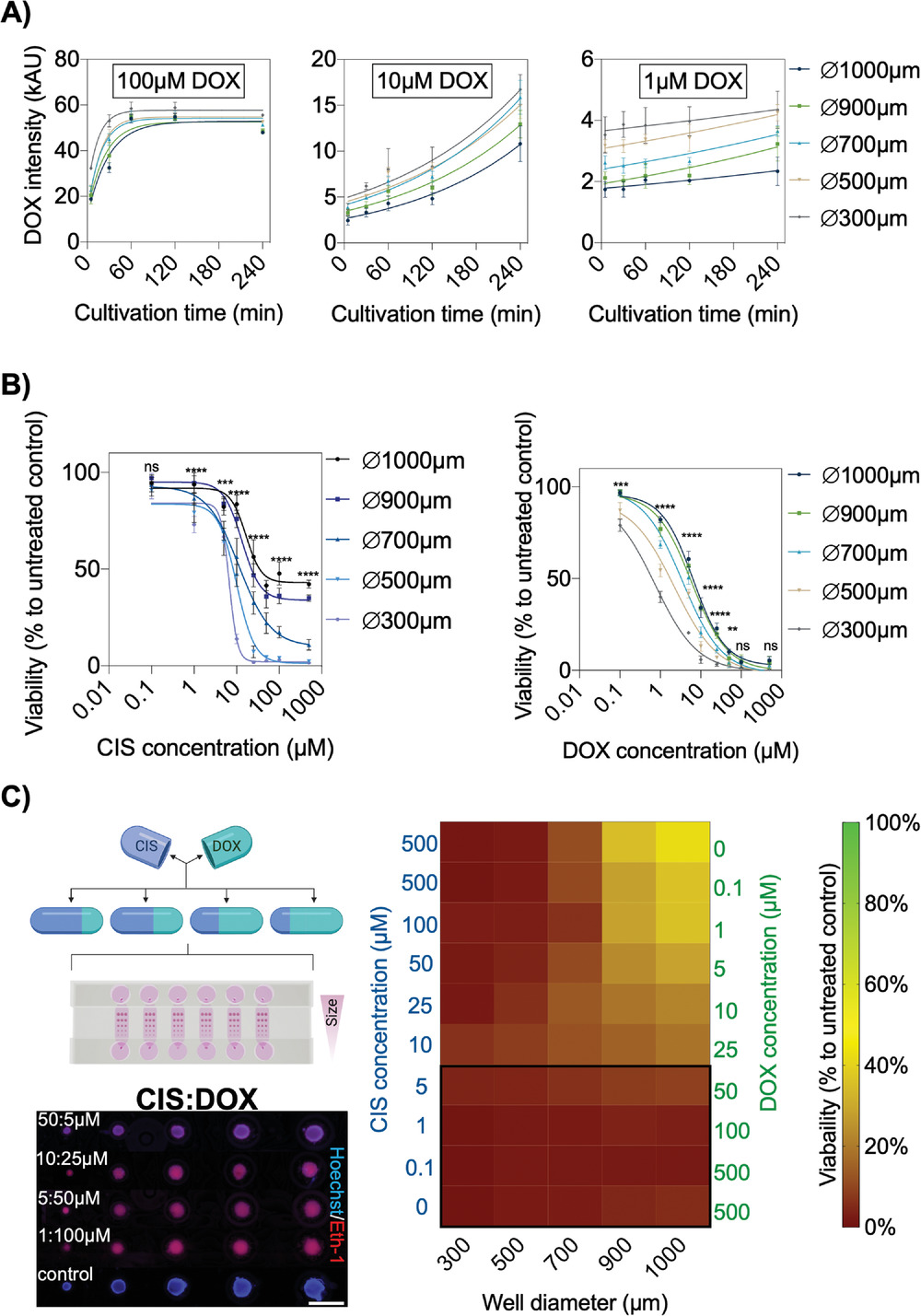
- (A)在4 h的培养期内监测100×10−6 M、10×10−6 M和1×10−6 M阿霉素(DOX)的A549肿瘤球渗透率。扩散率结果表明肿瘤球大小与药物渗透之间存在相关性。
- (B)顺铂(CIS)和阿霉素(DOX)处理的不同大小的A549肿瘤球,使用染料排斥法(dye exclusion assay)测定24 h的剂量反应关系(Hoechst:细胞核;EthD-1:死细胞)。
- (C)CIS和DOX的联合用药筛选,作用于不同尺寸的A549肿瘤球24 h。
Spheroid Size-Dependent Compound Penetration across an Advanced 3D Blood–Brain Barrier Model

- (A)接种6 d后,不同比例的的人类原代星形胶质细胞(hA)、人类原代周细胞(hP)和人脑微血管内皮细胞系(hCMEC/D3)的细胞球直径。这里是先加载hA过夜,使其成球然后再加载hP和hMCEC。
- (B)4 kDa FITC-葡聚糖(FD4)在 1 h后处理不同大小的BBB细胞球的荧光图。较大尺寸的细胞球中,FD4向球体核心聚集程度逐渐降低。
- (C)10×10−6 M FD4培养 4 h后,不同大小和细胞比例的细胞球的平均荧光强度。表明hA细胞球不存在功能性细胞屏障。
- (D)同细胞接种比例的大(900 µm)和小(300 µm)BBB细胞球的紧密连接相关蛋白闭锁小带ZO-1(橙色)的免疫荧光染色。细胞核用DAPI(蓝色)染色。显示出与内皮细胞含量成正比的ZO-1定位和厚度增加。
Table 4. Linear regression analysis and goodness-of-fit (R2) values of generated sizes of BBB spheroids after six days postseeding, including human primary astrocytes (hA), human primary pericytes (hP), and immortalized hCMEC/D3 (BEC) in a ratio of 1:1:3 in respect to initial seeding densities. Statistical significance of respective slopes was determined by analysis of covariance (ANCOVA).
| Seeding densities [cells mL−1] | |||||
|---|---|---|---|---|---|
| BBB triple-culture | 1.0 × 106 | 2.0 × 106 | 3.0 × 106 | 5 × 106 | p-value of slopes |
| hA:hP:BEC (1:1:3) | 0.9071 | 0.8389 | 0.9096 | 0.9318 | P = 0.0009 |
Table 5. Efficient Permeability Pe of BBB spheroids of different sizes and cell ratios after 1 and 4 h of cultivation with 10 × 10-6 M FD4.
| Efficient permeability Pe (10-6 cm s-1) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1000 µm | 900 µm | 700 µm | 500 µm | 300 µm | ||||||
| BBB seeding ratio (hA:hP:BEC) | 1 h | 4 h | 1 h | 4 h | 1 h | 4 h | 1 h | 4 h | 1 h | 4 h |
| 1:1:3 | 3.3 ± 0.6 | 7.8 ± 1.3 | 4.5 ± 1.1 | 8.3 ± 1.1 | 4.9 ± 2.0 | 8.9 ± 2.3 | 5.2 ± 0.5 | 9.1 ± 1.3 | 6.2 ± 2.9 | 10.6 ± 2.3 |
| 1:1:2 | 6.0 ± 0.5 | 8.8 ± 1.4 | 7.5 ± 1.6 | 9.9 ± 1.4 | 8.1 ± 2.8 | 10.0 ± 1.8 | 8.9 ± 1.1 | 11.3 ± 2.1 | 9.9 ± 2.4 | 11.4 ± 3.0 |
| 1:1:1 | 7.0 ± 2.2 | 11.5 ± 2.1 | 9.2 ± 1.4 | 12.7 ± 1.4 | 9.6 ± 1.8 | 14.2 ± 1.4 | 10.4 ± 2.3 | 13.3 ± 2.8 | 11.1 ± 3.7 | 13.5 ± 1.2 |
| 5.5:1.5:3 | 2.9 ± 0.7 | 7.1 ± 1.5 | 4.4 ± 1.0 | 8.3 ± 1.9 | 5.1 ± 1.3 | 8.7 ± 2.2 | 4.6 ± 0.7 | 9.5 ± 2.3 | 5.4 ± 2.0 | 11.2 ± 1.1 |
| 1:0:0 | 11.5 ± 3.0 | 12.7 ± 1.9 | 11.8 ± 3.3 | 13.8 ± 3.3 | 12.1 ± 2.4 | 14.6 ± 2.9 | 12.4 ± 3.4 | 15.3 ± 2.6 | 14.1 ± 3.0 | 16.9 ± 3.6 |
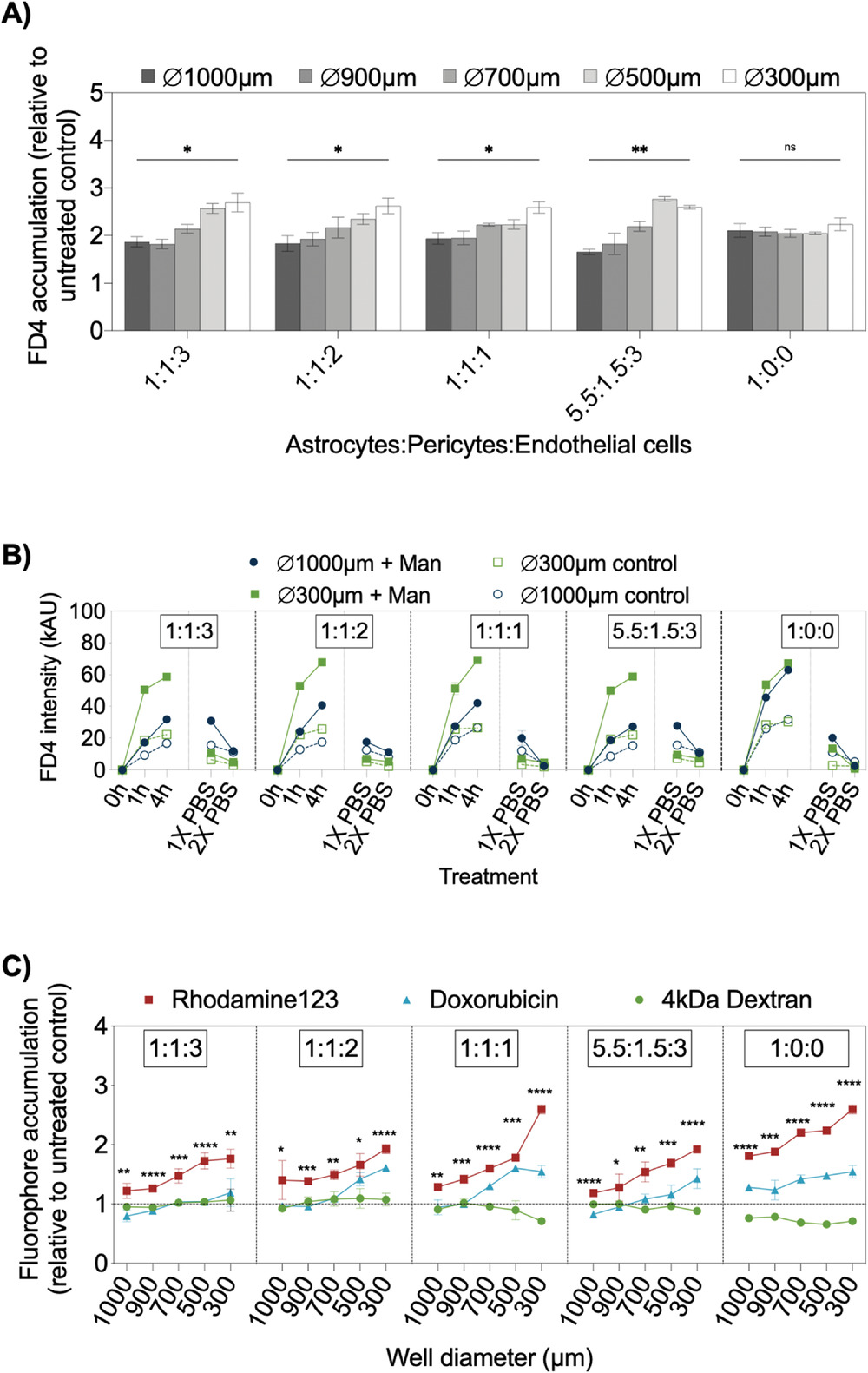
- (A)FD4在不同细胞比例和大小的甘露醇(Man,临床相关浓度1.6 M)处理的BBB细胞球的累积倍数变化。
- (B)最大(1000 µm)和最小(300 µm)BBB细胞球在处理和未处理的孵化过程中的时间分辨FD4强度分布。较小细胞球的 FD4信号强度比较大的和类似大小的未处理细胞球高得多,但和细胞比例无显著关系。两种大小的单星形胶质细胞球在甘露醇处理期间显示出荧光信号相当,证实不存在BBB屏障。使用PBS清洗细胞球以监测FD4流出,也可以观察到较大尺寸细胞球中的FD4信号更容易保持稳定。
- (C)100×10−6 M P-gp抑制剂维拉帕米(verapamil)/无维拉帕米处理的细胞球对10×10−6 M FD4、10×10−6 M 罗丹明123(rhodamine 123)、1×10−6 M 阿霉素孵育1 h后荧光积累影响。维拉帕米可抑制P-gp底物罗丹明123和多柔比星的外排,以检查多尺寸BBB细胞球的外排泵活性。结果表明:
- 维拉帕米不影响FD4的摄取,但能增加RHO和DOX的积累;
- 大尺寸细胞球中,DOX的积累不受维拉帕米处理的影响。
- 突出了均匀球体尺寸和细胞比率对于BBB复合吸收研究的重要性。
Conclusion
设计了一种微流控芯片系统,能可靠地生成大量定义尺寸的细胞球,具有更好地一致性。
优势:
- 通量更大且可以堆叠,比之前的微流控细胞球阵列通量更大;
- 动态微环境,有连续流动和剪切力;
- 单设备同时监测多个大小的细胞球;
- 首次体外构建三种细胞的BBB细胞球模型。
缺点:
- 没有可逆密封和肿瘤球的自动化回收,一个尺寸一个通道可能会更好。
总之,这种多尺寸细胞球的研究结果证实了化合物渗透、毒性和吸收的明显尺寸依赖性效应,也进行了CIS和DOX的联用研究。
顺铂:DNA合成抑制剂。
阿霉素:抑制拓扑异构酶II途径。
Reference
Eilenberger C, Rothbauer M, Selinger F, et al. A Microfluidic Multisize Spheroid Array for Multiparametric Screening of Anticancer Drugs and Blood–Brain Barrier Transport Properties[J]. Advanced Science, 2021, 8(11): 2004856.



